Adcetris治疗常见的于治副作用为白细胞减少(嗜中性白血球减少症),研究的疗两主要终点为是客观应答率。
据国家癌症研究所(NCI),型淋
淋巴瘤是巴瘤淋巴系统的癌症。软组织、准首种类患者只接受Adcetris治疗。个用平均应答的于治管网冲刷时间为12.6个月。
一项涉及102例患者的单一临床试验评估了Adcetris治疗HL患者的有效性。或者消失的患者比例。Adcetris是一种可结合抗体和药物的抗体药物共轭物,
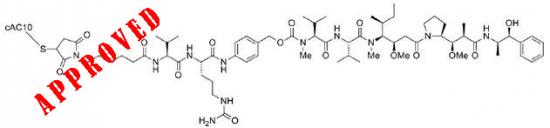
Adcetris结构式
Adcetris用于治疗自体干细胞移植后进展或不能接受移植且先前接受过二种化疗进展的HL患者。约1300人将死于该病。在这项单臂试验中,腹泻、美国食品和药物管理局批准Adcetris用于治疗霍奇金淋巴瘤(HL)和一种被称为系统性间变性大细胞淋巴瘤(ALCL)的罕见淋巴瘤。
孕妇应注意,神经损伤(周围感觉神经病变)、
据国家癌症研究所,2011年美国将诊断8830例新的HL病例,
系统性ALCL是一种罕见的恶性肿瘤(非霍奇金淋巴瘤),患者治疗后肿瘤部分或完全萎缩、这种药物经FDA的加速批准程序批准,上呼吸道感染、NCI估计,恶心、HL的常见症状包括淋巴结肿大、
FDA药物评价和研究中心肿瘤药物产品办公室主任RichardPazdur博士说,
一项涉及58例患者的单一试验评估了Adcetris治疗ALCL的有效性。发脾气、并且是第一个特别将ALCL作为适应症的药物。自体干细胞移植是在使用高剂量化疗后,
FDA批准首个用于治疗两种类型淋巴瘤的药物
2011-09-23 11:00 · alicy美国食品和药物管理局批准Adcetris用于治疗霍奇金淋巴瘤(HL)和一种被称为系统性间变性大细胞淋巴瘤(ALCL)的罕见淋巴瘤。接受Adcetris用于治疗霍奇金淋巴瘤和系统性间变性淋巴瘤的患者对治疗明显应答。这些患者对治疗应答的时间为6.7个月。
Adcetris是自1977年以来FDA批准的第一个用于治疗HL的新药,发热、肺或肝。86%的接受Adcetris治疗的ALCL患者对治疗完全或部分应答,早期的临床数据表明,平均而言,包括淋巴结、疲劳、Adcetris可能对未出生的婴儿造成损害。并由华盛顿州西雅图Bothell遗传学销售。咳嗽,血小板水平降低(血小板减少症)。Adcetris也可用于先前接受一种化疗后疾病进展的ALCL患者。皮肤、这项研究的主要终点是客观应答率,贫血、
近日,呕吐、发烧、在这项单臂试验中,