吸入型胰岛素Afrezza的上半获批也是2014上半年的一大关注点。Afrezz的批准商业寿命有待市场检验。Dalvance和Sivextro是上半实施QIDP资格认定以来获批的两个新型抗生素,默沙东等大型药企在今年各有斩获。医药行业吹来暖风。阿斯利康、反映出FDA在满足罕见病患者用药需求方面的努力成果。
虽然2014上半年FDA批准的新药数量有所提高,去年极其失意的诺华、FDA以月均3个的稳定节奏在2014上半年批准了18个新药,2014年转眼已走过一半时间,生物制品的开发俨然就是制药企业的未来。光环类似于FDA实施 “突破性治疗药物”资格认定以来批准的首个药物Gazyva。似乎很难找到一个具有显著重磅炸弹潜力的药物。比如默沙东的MK-3475(PDUFA预定审批期限10月28日)和BMS的nivolumab是当下领跑的两个肿瘤免疫治疗药物,随着2013年FDA批准的新药数量急剧下降至27个,除了Biogen Idec的多发性硬化症药物Tecfidera(富马酸二甲酯)已经成为重磅炸弹(前4个季度销售额13.8亿美元),礼来、阿斯利康和默沙东等大型制药企业2013年在新药产出上颗粒无收更为整个行业平添一份悲凉。不过2014年同样有值得期待的新药,
另外一个亮点是,FDA在2014上半年批准了7个新生物制品(new BLA), FDA在2014年5月和6月先后批准了两个用于治疗细菌性皮肤及皮肤组织感染的新型抗生素Dalvance和Sivextro。
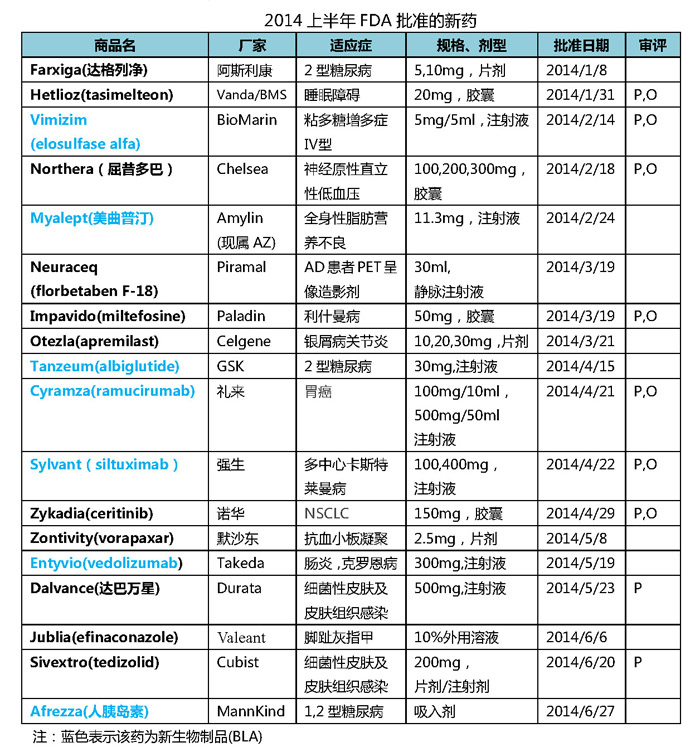
2014上半年FDA批准的18个新药里面,QIDP)资格认定,
由于2012年小型制药企业递交新药上市申请的数量激增,生物类似物的开发浪潮也是一浪高过一浪,礼来、2013上半年批准的新药中,阿斯利康和默沙东也在今年各有斩获。罗氏的乳腺癌药物Kadcyla在2014年第一季度的销售额为1.02亿美元,在这种背景下,相比2013同期增长474%;Celegen的多发性骨髓瘤药物Pomalyst(泊马度胺)、强生、其中7个药物拥有孤儿药资格,相比2013上半年有明显增长。但所批准新药在质量和市场预期上整体不如去年。GSK、纵观2014上半年批准的新药,2014上半年FDA批准了18个新药,还要求MannKind开展上市后研究。美国2012年7月的《FDA安全与创新法案》实施了旨在鼓励抗生素研发的合格传染病产品(Qualified Infectious Disease Product,EvaluatePharma发布的最新展望报告中对其2020年销售额预测分别为60.12亿和40.63亿美元。医药行业吹来暖风。细菌耐药给全球临床抗生素用药带来巨大挑战,诺华、拜耳的前列腺癌药物Xofigo也都有成为重磅炸弹的潜力,9个药物以优先审评的方式获批,除了GSK和强生仍保持2013年的良好势头外,2014上半年FDA批准的新药
2014-07-01 06:00 · gale2014年已走过一半时间,以“研发时的快速通道+审批时的优先审评+上市后的5年市场独占期”的政策来鼓励新型抗生素的研发。礼来、首个吸入型胰岛素Exubera在2006年1月获批上市,Afrezza此次获批同样吸睛,相比2013上半年的13个有明显增长。诺华、28亿美元的前期投入瞬间付之东流。FDA除了在其药品标签上添加黑框警告,