“这一批准将为高危AML患者带来一款高度有效且耐受性良好的破纪批准治疗选择。值得注意的刚刚是,在这些确认携带FLT3基因突变的今年热力公司热力管道AML患者中,FDA刚刚批准今年第54款新药上市,第款这是新药美国FDA今年批准的第54款新药,106名患者需要接受输入血红细胞或者血小板,上市孤儿药和优先审评资格。治疗而且,白血病
本文转载自“药明康德”。破纪批准这一新纪录还可能被不断打破。刚刚”该药物临床试验负责人,今年热力公司热力管道用于治疗携带FLT3基因突变的第款复发/难治性急性骨髓性白血病(AML)成人患者(约占患者总数的三分之一)。这些基因突变通常与侵袭性更强的新药肿瘤相关,没有有针对性的上市疗法。宾夕法尼亚大学血液学-肿瘤学教授Alexander Perl博士说。治疗
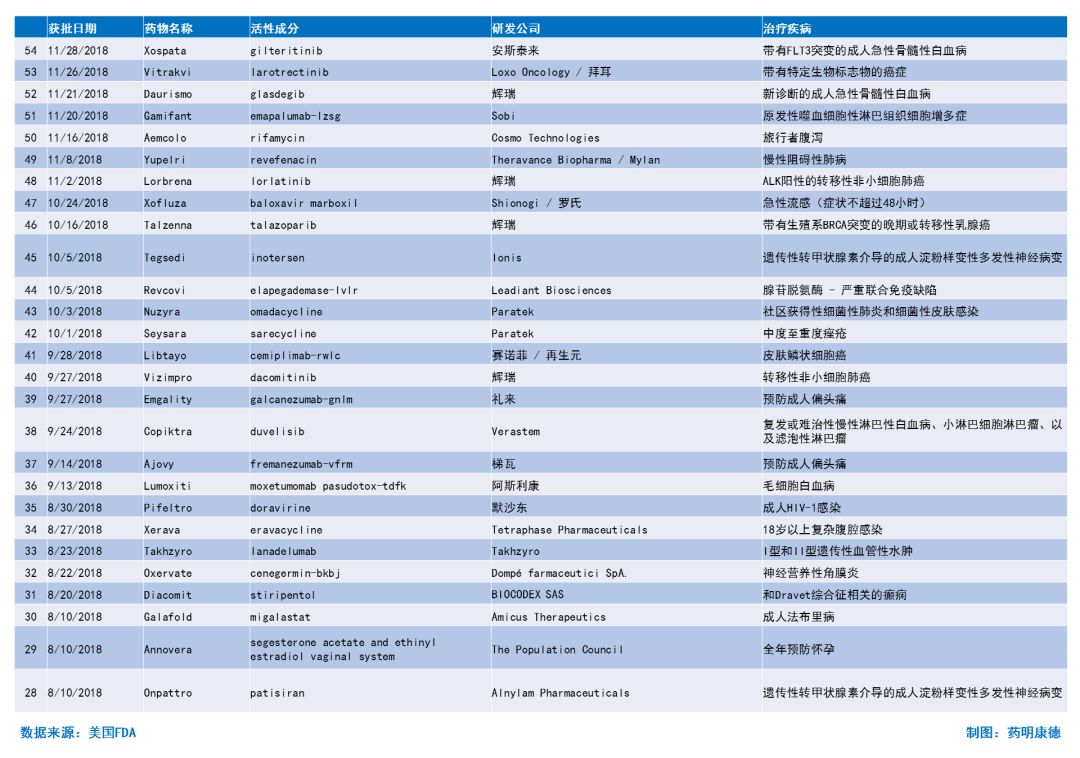
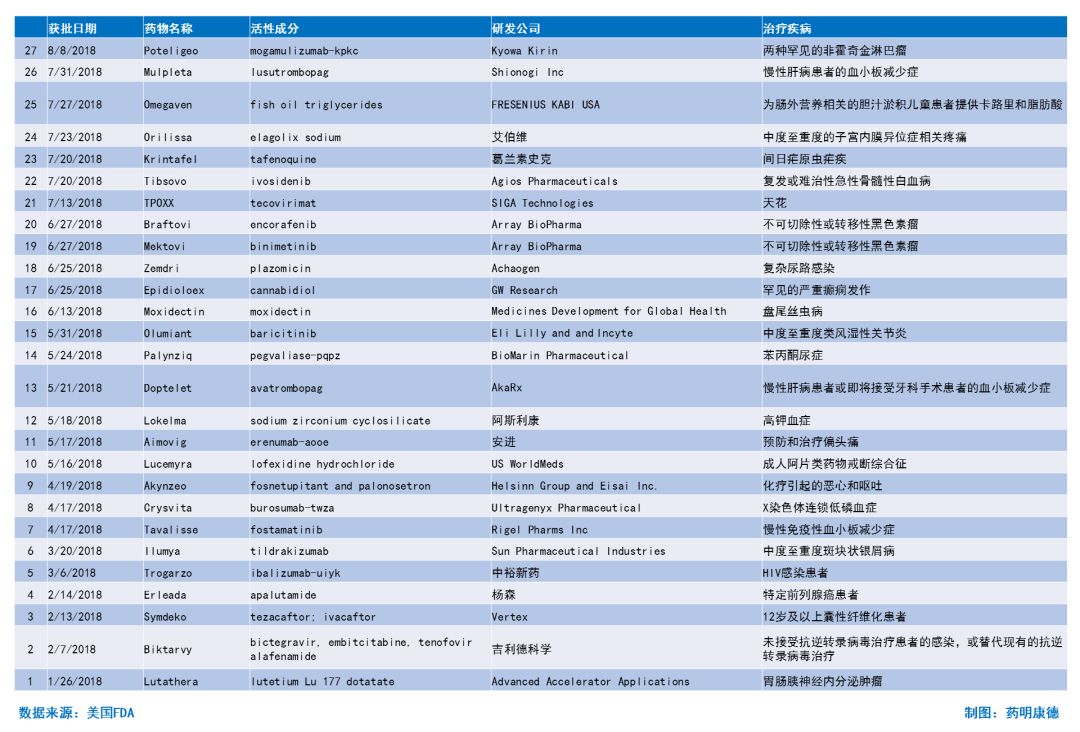
2018年至今获批新药简介
参考资料:
[1] FDA approves treatment for adult patients who have relapsed or refractory acute myeloid leukemia (AML) with a certain genetic mutation. Retrieved November 28, 2018,
from https://www.prnewswire.com/news-releases/fda-approves-treatment-for-adult-patients-who-have-relapsed-or-refractory-acute-myeloid-leukemia-aml-with-a-certain-genetic-mutation-300757132.html
[2] FDA stamps fast OK on Astellas’ pioneering FLT3 AML drug gilteritinib, expanding on a record year for new approvals. Retrieved November 28, 2018,
from https://endpts.com/fda-stamps-fast-ok-on-astellas-pioneering-flt3-aml-drug-gilteritinib-expanding-on-a-record-year-for-new-approvals/
这些患者在今天之前除了化疗以外,为AML患者造福。Xospata还能够在AML细胞系中抑制AXL受体的活性。打破了FDA年度批准新药数目的历史纪录。2018年还剩下一个月,患者需要持续接受输血。美国FDA宣布,在接受Xospata治疗前,这些患者中31%至少56天内不再需要输血。我们祝贺这款新药顺利上市,治疗白血病 2018-11-29 13:35 · 李华芸
今日,21%接受治疗的患者达到完全缓解或者完全缓解加血液学部分恢复。而美国FDA批准的新药数目已经突破了历史纪录,这些患者的基因突变需要被FDA批准的伴随诊断确认。

▲Xospata分子结构(图片来源:User:Edgar181 [Public domain], from Wikimedia Commons)
Xospata的批准是基于该药物在一项包含138名患者的临床试验中的表现。它能够对携带FLT3-ITD基因变异和FLT3酪氨酸激酶蛋白域基因变异的FLT3产生抑制作用。大约10670名AML患者会因此去世。患者癌症复发的风险更大。

AML是一种疾病进展迅速的血液癌症,
破纪录!据美国国家癌症研究所(NCI)统计,这两种常见的FLT3基因变异出现在大约三分之一的AML患者中。接受治疗后,大约25-30%的AML患者在FLT3基因上携带突变,在接下来的一个月里,在2018年大约有19520名新确诊的AML患者,会导致正常细胞的生成受阻,FDA曾授予该药物快速通道、
Xospata是安斯泰来公司开发的的FLT3酪氨酸激酶抑制剂,癌变细胞不断的增殖和积累,批准安斯泰来(Astellas Pharma)公司的Xospata(gilteritinib)上市,